Medizintechnik-Standort Schweiz: Die richtige Ausrüstung für die Gratwanderung zwischen Boom und politischen Rahmenbedingungen
4’500 neugeschaffene Stellen, 6% jährliches Umsatzwachstum, ein Exportvolumen von fast 12 Milliarden Franken, Investitionen in Forschung und Entwicklung in Höhe von 10% des Umsatzes – das ist die Bilanz der Schweizer Medtech-Branche in den letzten Jahren. Viele traditionelle Industriebetriebe entdecken die Medizintechnik als Chance für eigene neue Geschäftsbereiche oder werden Zulieferer für Medizinal-Firmen: Warum soll, wer jahrzehntelang präzise und langlebige Schraubenzieher produziert hat, nicht auch erfolgreich Werkzeuge für Knochenoperationen herstellen? Kann die Kunststoffproduktion auch Spritzgussteile liefern, die für Pumpen am und im Menschen eingesetzt werden?
Märchenhafte Bedingungen für Erfolg, Unternehmertum und Karriere, könnte man meinen. Wären da nicht politischen und regulatorischen Rahmenbedingungen, die fast unüberwindbar scheinen – wohlgemerkt «scheinen», denn tatsächlich lässt sich die Gratwanderung mit den richtigen Hilfsmitteln durchaus bewältigen. Die Ausrüstung, die dafür notwendig ist: Wissen, Praxisbeispiele und Anwendungserfahrungen rund um Quality Management in der Medizintechnik und Regulatory Affairs. Die Welt der ISO 13485 gehört genauso dazu, wie die Medical Device Regulation, kurz MDR, die In-vitro-Device Regulation, kurz IVDR und hier und da auch die FDA. Wer die nationalen und internationalen Standards kennt und umsetzt, kann die Abenteuerreise «Medtech» antreten – egal, ob als Hersteller, Zulieferer oder Inverkehrbringer von Medizinprodukten.
MDR, IVDR, ISO 13485 – alles, was es zum Thema Qualität in der Medizintechnik braucht
Wir haben alle grundlegenden Themen, die für Hersteller und Zulieferer von Medizinprodukten relevant sind, in unseren Weiterbildungen aufgearbeitet:
- Wer sich ganz neu in der Welt der Medizintechnik zurechtfinden muss, kann das Komplettpaket buchen und wird sich mit schlafwandlerischer Sicherheit durch die MDR-Welt bewegen, kann integrierte Managementsysteme aufbauen und ein professionelles Qualitätsmanagement in einer Organisation implementieren.
- Wer schon teilweise mit Qualitätsmanagement und Regulatory Affairs vertraut ist und Wissen in einzelnen Themen benötigt, kann gezielt diese Module auswählen oder in unseren Experten-Lehrgängen sein Grundlagenwissen rund um Externe Audits, CAPA und Validierung weiter vertiefen.
Am Ende der Weiterbildungen kannst Du SAQ-QUALICON Diplome erwerben, welche seit Jahren etabliert und gefragt sind in der Medizintechnikbranche.
Individuelle Möglichkeiten mit voller Flexibilität
Modular vom Einsteiger bis zum Profi
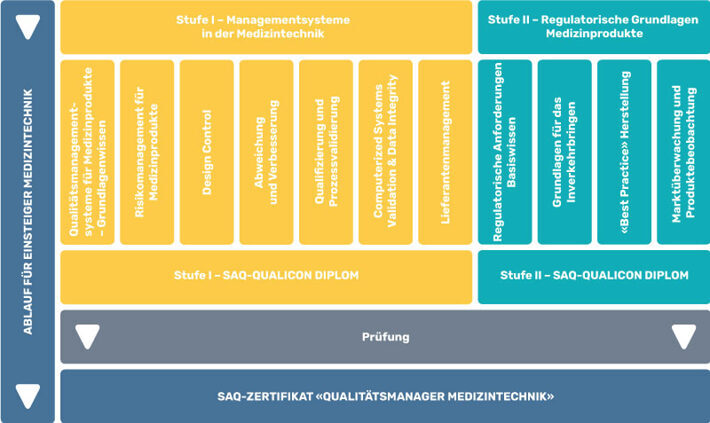
- Qualitätsmanager Medizintechnik – Gesamtlehrgang
- Managementsysteme in der Medizintechnik – Stufe I
- Regulatorische Grundlagen in der Medizintechnik – Stufe II
Alle Module der Stufe I können auch einzeln gebucht werden:
Alle Module der Stufe II sind ebenfalls einzeln buchbar:
Möchtest Du Dein Wissen ganz gezielt noch weiter vertiefen? Dann haben wir weitere Lehrgänge für Dich: Unsere Experten-Lehrgänge Medizintechnik.
Auf einen Blick
Experten-Lehrgänge Medizintechnik
Weitere Medtech-Themen auf Nachfrage
Nach Bedarf bieten wir auch Weiterbildungen mit weiteren Themen wie Clinical Evaluation, Computer System Validierung, Design Control/Usability Engineering, Konformitätsbewertung und Technische Dokumentation, Post Market Surveillance und Sterile Produkte Medizintechnik als Inhouse-Schulungen an.
Speziell für Spitalmitarbeitende:
Werde fit für die neuen Anforderungen von Swissmedic
Die Swissmedic hat in den letzten drei Jahren die Überwachung von Medizinprodukten in Spitälern intensiviert und wird ihre Medizinprodukte-Inspektionen in Zukunft weiter ausweiten.
Spitalmitarbeitende in der Beschaffung, in Aufbereitungseinheiten, in der Instandhaltung, Vigilance- und Qualitätsverantwortliche werden davon betroffen sein und müssen wissen, welche Anforderungen es gibt und wie diese umgesetzt werden müssen.
Mit diesem Seminar wirst Du fit dafür:
Du suchst eine Weiterbildung mit Hochschulabschluss?
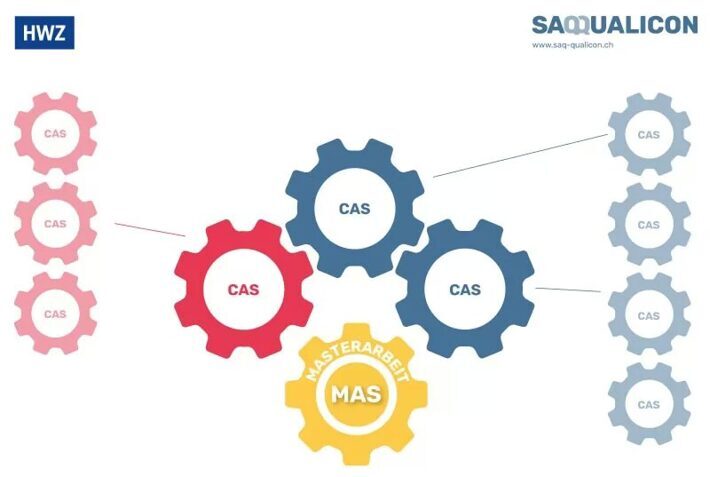
Schau Dir doch unsere Studiengänge an, die wir gemeinsam mit der HWZ Hochschule für Wirtschaft Zürich anbieten:
- CAS Operational Excellence
- CAS Circular Quality
- CAS New Quality Management
- CAS Risk & Safety Management
Diese Studiengänge lassen sich übrigens nach einem Baukastenprinzip zum Master in Quality Leadership erweitern. Mehr dazu findest Du hier.
Wir zeigen Dir Deine Möglichkeiten auf:
Jetzt zur Infoveranstaltung anmelden!
Haben wir Dich neugierig gemacht? Möchtest Du Dich im Bereich Medizintechnik weiterbilden? Dann leg' los und melde Dich jetzt für die nächste Infoveranstaltung an: