Von MDD zu MDR
Die regulatorischen Anforderungen im Bereich der Medizintechnik unterliegen aktuell einem Übergang zwischen zwei Regelwerken. Gültig war bislang die seit 1993 bestehende Richtlinie 93/42/EWG über Medizinprodukte (Medical Device Directive – MDD), die durch die Verordnung (EU) 2017/745 (Medical Device Regulation – MDR) bereits abgelöst wurde. Hersteller von Medizinprodukten müssen seit dem endgültigen Geltungsbeginn der MDR ihre Technische Dokumentation (TD) auf die Anforderungen der MDR anheben.
Die MDR konkretisiert neu und ergänzt an vielen Stellen die Anforderungen, die es zu erfüllen gilt. Sie stellt weitere Anforderungen an formale Kriterien wie Medium, Format, Inhalt und Lesbarkeit sowie Anpassung der Informationen für die adressierten Zielgruppen bzw. Stakeholder.
So stehen nun viele Hersteller vor der Herausforderung, ihre Technischen Dokumentationen auf Vordermann zu bringen, um den Anforderungen der MDR gerecht zu werden. Chantal zeigte uns, wie sie vorgegangen ist und welche Erfahrungen sie gemacht hat:
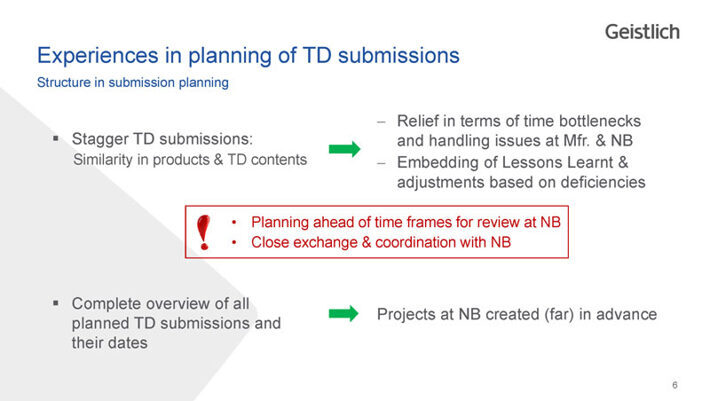
Erfahrungen in der Planung von TD-Einreichungen
Struktur bei der Einreichungsplanung
Staffle die TD-Einreichungen
- Meistens gibt es bereits ähnliche Produkte mit entsprechend ähnlichen TD-Inhalten, die als Basis verwendet werden können. So entlastest Du nicht nur die internen Fachkräfte, sondern auch die der «Notified Bodies» (NB).
- Erkenntnisse, die aus schon laufenden oder abgeschlossenen TD-Einreichungen gewonnen wurden und Anpassungen aufgrund von Mängeln sollten ebenfalls gesammelt und implementiert werden.
Nachfolgend noch zwei Tipps:
- Plane grosszügige Zeitfenster für die Überprüfungen bei den NB ein.
- Tausche Dich aktiv mit den NB aus und stimme Dich für eine gute Zusammenarbeit ab.
Erstelle eine vollständige Übersicht
- Erstelle eine vollständige Übersicht aller geplanten und laufenden Einreichungen von Technischen Dokumentationen mit deren Terminen. Die Übersicht sollte weit im Voraus erstellt sein, da TD-Einreichungen in der Regel zeitintensive Prozesse sind.
Stimme Dich schon bei der Planung unbedingt mit den NB ab. Es gibt auf Europäischer Ebene momentan zwar keine einheitlichen Vorgaben, nur diejenigen zu erfüllenden Anforderungen aus der MDR, aber die NB haben im Rahmen ihrer eigenen Umsetzung der MDR in der Regel Strukturen für die TD definiert. Mit einem entsprechend übersichtlichen Aufbau kannst Du punkten, was den NB ermöglicht, Projekte bereits im Voraus zu eröffnen.
Erfahrungen in der Planung von TD-Einreichungen
Einflussfaktoren auf die Planungssicherheit
Die Planung wird durch viele verschiedene Faktoren erschwert:
- Engpässe bei der Verfügbarkeit von Experten bei den NB
- Aufgrund nötiger spezifischer Befragungen bei Behörden (bspw. Expertengremium), welche bestimmte abgeschlossene TD Assessment-Module bei den NB bedingen
- Dauer der Überprüfung bei der Zertifizierstelle kann je nach Auslastung sehr unterschiedlich sein
- Interne Verfügbarkeit von Fachexperten für Nachfragen von den Reviewern bei den NB und Mängelberichten
Ziel sollte es sein, die Wahrscheinlichkeit von Zeitproblemen so weit wie möglich zu verringern. Nachfolgend ein paar Tipps:
- Plane zusätzliche grosszügige Zeitreserven ein.
- Erstelle die Planung in enger Zusammenarbeit und in aktivem Austausch mit den NB. Frage proaktiv nach Fristen und hinterfrage die Machbarkeit des Zeitplans (realistische Zeitschienen).
- Tausche Dich regelmässig mit Deinen internen Stakeholdern (bspw. Fachexperten) aus und informiere diese über den Stand der TD Assessments.
Organisatorische Struktur
Eine tägliche Herausforderung bei der Erstellung einer TD ist das benötigte Fachwissen, das zur Verfügung stehen muss. Idealerweise arbeiten die Fachabteilungen und Regulatory Affairs zusammen: Die Verordnung stellt viele regulatorische Anforderungen und verschiedene Begriffe sind mit Definitionen belegt, welche die anderen involvierten Fachkräfte nicht immer kennen – und dies auch nicht müssen.
Deshalb empfahl Chantal, sich entsprechend zu organisieren:
Verantwortliche*r Einreichungsleiter*in
Für die Position sollte es eine Person geben, die sprichwörtlich pro TD das Zepter in der Hand hat und die Einreichung der TD und deren Mängel sowie die Kommunikation mit den NB koordiniert. Sie ist Dreh- und Angelpunkt für alle internen und externen Stakeholder. Diese Person kann je nach Unternehmen für die Einreichung einer oder mehrerer TD zuständig sein. Die Hauptaufgaben sind:
- Überblick über die Fristen der TD-Einreichung(en)
- Zentrale Kontaktstelle für den Austausch mit der NB
- Hauptverantwortung für die Mängelbehandlung
- Koordination der Fachexperten
- Internes Kommunikationszentrum
Zuständige Fachexperten
Die Fachexperten werden für die jeweiligen Teile der TD herangezogen. Das sind ihre Hauptaufgaben:
- Für einen spezifischen Inhalt in der TD verantwortlich oder als Reviewer involviert (in Zusammenarbeit mit Regulatory Affairs)
- Beantwortung von Fragen und Behebung von Mängeln, welche diesen Bereich tangieren
- Nachdokumentationen
Phase-out von Legacy-Produkten (keine MDR-Zertifizierung geplant)
Wenn sich ein Medizintechnikprodukt in der Phase-Out-Phase befindet, weil man es keiner MDR-Remediation unterziehen möchte, bedeutet dies, dass es nicht mehr aktiv vermarktet wird und nach und nach vom Markt genommen wird. Dies kann passieren, wenn die Kosten-Ertrags-Analysen für die Zukunft negativ ausfallen oder der Aufwand für eine erneute Zertifizierung zu gross ist. Beim Aufwand für die Pflege der TD sollte nicht nur der finanzielle Aspekt berücksichtigt, sondern auch der personelle Aufwand mit einberechnet werden.
Darauf solltest Du achten:
- Überprüfe die regulatorischen Anforderungen: Wenn Du das Produkt auslaufen lässt, solltest Du sicherstellen, dass Du bzw. Dein Unternehmen alle regulatorischen Anforderungen bis zum Schluss erfüllst.
- Informiere alle Stakeholder: Alle sollten rechtzeitig über die bevorstehende Einstellung der Produktion informiert werden.
- Plane den Ausstieg: Es ist wichtig, einen Plan für den Ausstieg aus dem Markt zu haben. Überwache hierfür den Lagerbestand und die Absatzplanung mit Einberechnung der «Shelf Life» (26. Mai 2024 in Bezug auf die Anforderungen der Verordnung (EU) 2023/607) und sorge dafür, dass so wenig Produkte wie möglich entsorgt werden müssen.
Empfehlenswert ist das Studieren des Q&A zur Implementierung des 2. Amendments der MDR.
- Neue Evaluierung der TD für Legacy-Produkte
Legacy-Produkte (nach den Anforderungen der MDD zugelassen) werden nochmals detailliert nach den Anforderungen der MDR evaluiert, auch wenn sie bereits durch die NB erfolgreich zertifiziert sind und die MDCG 2022-14 eingeführt wurde. Diese stellt eigentlich eine Anleitung zur verschnellerten Evaluierung der TD für Legacy-Produkte für die NB dar und beschreibt die Verfügbarkeit der Medizinprodukte. - Klinische Bewertungen und Behauptungen
Klinische Bewertungen und Behauptungen sind in der TD unerlässlich, um die Sicherheit und Wirksamkeit von Medizinprodukten zu gewährleisten und die Konformität mit den regulatorischen Anforderungen sicherzustellen. - IFU und SSCP
Mit der MDR 2017/745 Art. 32 müssen Hersteller für implantierbare Produkte und für Produkte der Klasse III, die keine Sonderanfertigungen oder Prüfprodukte sind, einen Kurzbericht über Sicherheit und klinische Leistung (SSCP) vorlegen.
Dabei handelt es sich um eine Zusammenfassung der klinischen Daten und anderer Informationen über die Sicherheit und klinische Leistung des Medizinprodukts.
Die SSCP ist ein zusätzliches Dokument zur Gebrauchsanweisung (IFU), zum Implantat Pass oder zu anderen obligatorischen Dokumenten. Das SSCP hat objektiv zu sein und fasst günstige und ungünstige Daten zusammen.
IFU und SSCP sollen mit der Klinischen Dokumentation übereinstimmen. - Verpackung
Die Verpackung ist in der Medizintechnik ein wichtiger Aspekt, der in der TD angemessen beschrieben werden muss, wie zum Beispiel:
- Design und Materialien
- Leistungstests in Bezug auf Schutz, Stabilität, Druckfestigkeit etc.
- Etikettierung inklusive aller Kennzeichnungen und Warnhinweisen sowie Anweisungen zur Handhabung und Entsorgung
- Transport und Transportart
- Konformität (Anforderungen an die Qualität und Sicherheit) - Korrekte Prozessvalidierungen – Ausreichende Beschreibung der Worst-Case-Produkte
Eine gründliche Beschreibung der Worst-Case-Produkte ist wichtig, um sicherzustellen, dass die Ergebnisse einer Prozessvalidierung auf alle Produkte angewendet werden können, die im Geltungsbereich der Validierung liegen.
Eine korrekte Prozessvalidierung ist ein wichtiger Bestandteil des Risikomanagements in der Medizintechnik. Sie dient dazu, sicherzustellen, dass der Produktionsprozess reproduzierbar und konsistent ist und dass die Produkte den spezifizierten Anforderungen entsprechen. Wenn die Worst-Case-Produkte nicht ausreichend beschrieben sind, kann dies zu ungenauen oder unvollständigen Ergebnissen und möglicherweise zu einer unzureichenden Prozessvalidierung führen. Die NB sind in ihren Reviews in Bezug auf Worst-Case-Betrachtungen sehr fokussiert.
Lessons Learned
In Bezug auf die TD-Einreichung
- Feste Struktur bzw. Kapitelreihenfolge bei allen Technischen Dokumentationen
Nicht nur für den internen Gebrauch mit den Fachpersonen, sondern auch im Austausch mit den NB hilft das weiter – alle finden sich schneller zurecht. - Mängelberichte
- Frühzeitige Abklärung mit den NB – Nachfrage nicht scheuen und «am Ball» bleiben
- Anfechten von Mängeln – abklären, ob es gerechtfertigte Mängel sind und rückfragen bei Unklarheiten in Mängelberichten - Gelöste Mängel
In den nachfolgenden oder bereits im Review stehenden TD alle gelösten Mängel berücksichtigen (evtl. bereits ein Update von Dokumenten machen) - Konstruktive Eskalationskultur pflegen
Gegenseitiges Verständnis zwischen dem «Muss» seitens der NB und dem «Kann» seitens dem Hersteller aufbauen und pflegen - Zusammen – Hersteller und NB – durch die MDR-Übergangsphase
Mit Ehrlichkeit, Offenheit und Transparenz von beiden Seiten zusammen Lösungen erarbeiten
Ziel sollte es sein, sich gegenseitig zu unterstützen, um zusammen schnellstmöglich zum Ziel zu kommen – die MDR-Zertifizierung. Nachfolgend zwei Tipps:
- Frage aktiv bei den NB nach – «bleibe am Ball»
- Halte die Überprüfungszeiträume für die TD Assessments möglichst so ein, dass es zu keinen Verschiebungen bei den NB kommt
Neben einer engen Zusammenarbeit mit den NB ist eine sorgfältige Vorbereitung und Überprüfung der TD entscheidend, um eine reibungslose Einreichung und möglichst unkomplizierte und rasche Zulassung des Medizinprodukts zu gewährleisten.
Abwicklung von Produktänderungen während der MDR-Umstellung
Produktanpassungen während der MDR-Übergangsphase sind ein heikles Thema. In einem solchen Fall solltest Du zwingend systematisch vorgehen:
- Nach Wichtigkeit und Dringlichkeit einordnen – stelle Dir und den entsprechenden internen Stakeholdern die Frage: Wie wichtig und dringend ist die Änderung?
- Klassifizierung von Anpassungen (nicht wesentlich/wesentlich, nicht signifikant/signifikant) (NBOG 2014-3, MDR. Art. 120 und MDCG 2020-3)
Empfehlung: Statement für Erfüllung/Nicht-Erfüllung von MDR Art. 120 und MDCG 2020-3 verfassen, evtl. mit der Änderungsmeldung bei den NB einreichen - Implementierung
- Abhängigkeiten abklären (inhaltliche und zeitliche Prioritäten)
- Verschiedene Szenarien durchgehen, die zur Entscheidung führen (abhängig der Signifikanz unter MDR):
· Verschiebung nach der MDR-Zertifizierung: Kann man so lange warten?
· Einbettung in die MDR-Zertifizierung: Kann man es noch in den Prozess reinnehmen?
· Beschleunigung
- Wenn möglich, unter MDD noch ändern
- «Fast-Track» bei den NB anfragen (beschleunigtes Verfahren)
Du musst in der Lage sein, intern wie auch extern den NB die Prioritäten und Abhängigkeiten erklären zu können. Eine transparente Kommunikation und enge Abstimmung mit allen Beteiligten können unnötige Engpässe vermeiden. Doch so oder so erhöhen Produktanpassungen während der Übergangsphase in die MDR-Konformität die Komplexität des Prozesses sehr. Erstelle darum unbedingt eine Trackingliste, wann welches Modul der TD sich voraussichtlich im Assessment bei den NB befindet. Mit einer abgespeckten Übersicht dessen können sich die NB frühzeitig auf die zukünftigen Änderungen einstellen, was die Zusammenarbeit fördert.
Mögliche Auswirkungen von Änderungen während der MDR-Übergangsphase sind:
- Es kann Verspätungen geben.
- Laufende oder geplante TD Assessment-Module kommen in die Warteschleife des Reviews bei den NB bis es verfügbare Zeitfenster oder Reviewer gibt.
- Es besteht das Risiko, dass gewisse Assessment-Module nochmals angeschaut werden, was zu einer Öffnung deren führt.
Erfahrungen in der Planung des Phase-Out von Legacy-Produkten und Phase-In von MDR-konformen Produkten
Wenn MDD-konforme Medizinprodukte durch MDR-konforme in den Markt eingeführt werden sollen, muss auf gewisse Dinge geachtet werden:
- Änderungsanforderung: Aktionen definieren und Massnahmen nachvollziehbar machen
- Verkaufsplanung
· Benötigte Produktmenge für die Umstellung von MDD- auf MDR-konforme Produkte eruieren und sicherstellen, um Verschrottung von Produkten und z.B. Verpackungsmaterialien tief zu halten
· Kein Verkaufsvorrat nötig (Fristverlängerung gemäss Einhaltung der Anforderungen der Verordnung (EU) 2023/607) - Kennzeichnung und Verwaltungsmassnahmen: Zeitpunkt für die Umstellung und Menge für die Konvertierung festlegen
- Interne EUDAMED-Stammdatenblätter aktualisieren
- Markt/Stakeholder informieren, dass es eine Übergangsfrist geben wird, die unterschiedliche gesetzliche Anforderungen konform abdeckt
Fazit
Eine klare, organisierte, leicht durchsuchbare und eindeutige Technische Dokumentation (TD) ist in Bezug auf die Medizinprodukte-Verordnung (MDR) unabdingbar, weil sie der zentrale Bestandteil der Konformitätsbewertung von Medizinprodukten ist. Diese Dokumentation muss während des gesamten Lebenszyklus eines Medizinprodukts auf dem neuesten Stand gehalten werden.
Die TD enthält unter anderem Angaben zu Design und Herstellung des Produkts, Leistungsmerkmalen, Spezifikationen, Konstruktionszeichnungen, Risikoanalysen, Ergebnissen klinischer Bewertungen, Ergebnissen von Tests und Prüfungen, Verpackungs- und Kennzeichnungsdetails sowie zur Gebrauchsanweisung und deren zugehörigen Dokumenten. Diese Informationen sind wichtig, um sicherzustellen, dass das Produkt den relevanten regulatorischen Anforderungen entspricht und dass es für den beabsichtigten Zweck sicher und wirksam ist.
Um den administrativen und koordinativen Aufwand rund um die TD im Griff zu haben, sind vor allem zwei Dinge wichtig:
- Eine offene, transparente und ehrliche Kommunikation zu allen Stakeholdern.
- Ein Faible für die Koordination mit einer Prise Organisationstalent.
Wenn Du die PowerPoint-Präsentation downloaden möchtest, dann klicke hier auf diesen Link. Weitere QQ-Impulse findest Du jeweils auf unserer Webseite bei den Events.
Haben wir Dich neugierig gemacht? Möchtest Du noch mehr wissen? Nachfolgend haben wir ein paar Weiterbildungen für Dich zusammengestellt: